- 科研进展
-
刘西莉教授团队在大豆疫霉线粒体自噬机制研究中取得新进展
作者: 来源: 发布日期:2024-03-05 浏览次数:近日,我室刘西莉教授团队在期刊《Nature Communications》上在线发表了题为“PsAF5 functions as an essential adapter for PsPHB2-mediated mitophagy under ROS stress in Phytophthora sojae”的研究论文。该研究报道了含ANK和FYVE结构域的蛋白PsAF5作为线粒体内膜自噬受体PsPHB2的配体,通过影响PsPHB2与PsATG8的互作而参与调控大豆疫霉响应活性氧的线粒体自噬机制。已毕业博士研究生李文浩、博士研究生朱宏伟和陈金珠为文章的共同第一作者,苗建强副研究员和刘西莉教授为论文共同通讯作者

寄主植物响应病原菌侵染后能在其细胞质外体空间产生活性氧(Reactive oxygen species,ROS),是植物先天免疫系统的重要防御反应,而线粒体作为细胞物质和能量的代谢中心,不仅是细胞内活性氧的主要来源,也是活性氧损伤的主要靶向对象。目前,病原菌效应蛋白如何抑制寄主ROS的产生已被广泛研究,然而,关于植物病原卵菌在侵染过程中如何增加ROS耐受能力并维持线粒体稳态的问题尚不清楚。
本研究首先通过生物信息学分析,发现大豆疫霉中存在10个同时含有ANK和FYVE结构域AFs基因,并对这类基因进行了敲除与表型分析。发现PsAF5敲除转化子对H2O2敏感性增加,致病力显著降低,推测PsAF5是大豆疫霉响应ROS胁迫的重要因子。进一步研究发现,活性氧处理下PsAF5与PsATG8的互作和共定位均增强(图1),而且PsAF5的敲除能够阻止活性氧处理和线粒体自噬诱导剂处理条件下的线粒体自噬发生。
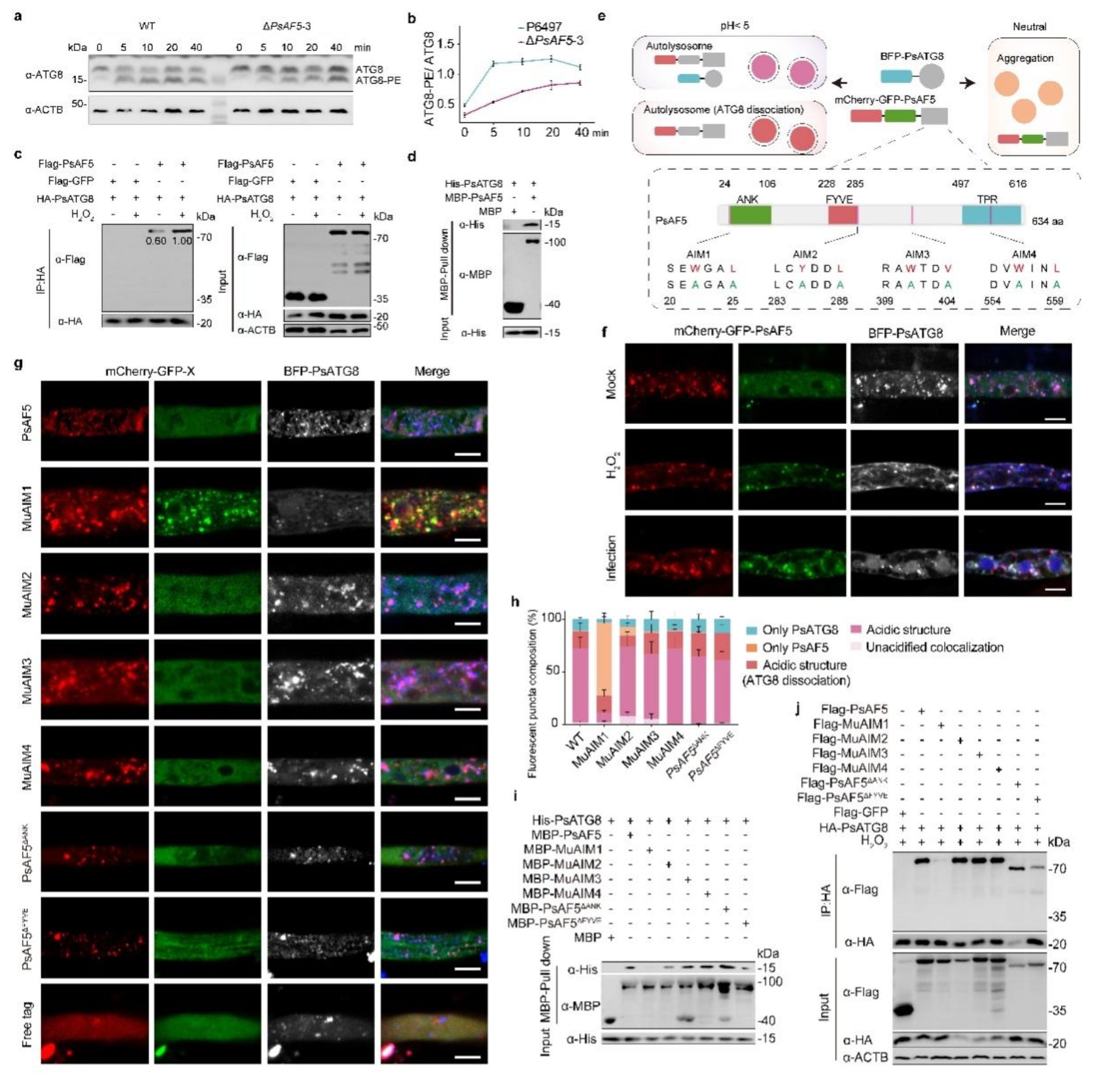
图1 PsAF5上的AIM1基序是其与PsATG8的互作和共定位的关键区域
蛋白互作及系列验证试验表明,PsAF5通过ANK结构域与线粒体内膜蛋白PsPHB2互作从而被招募到受损线粒体(图2),且线粒体在活性氧压力下受损导致的PsPHB2外露是其与PsAF5互作的必要条件(图3)。
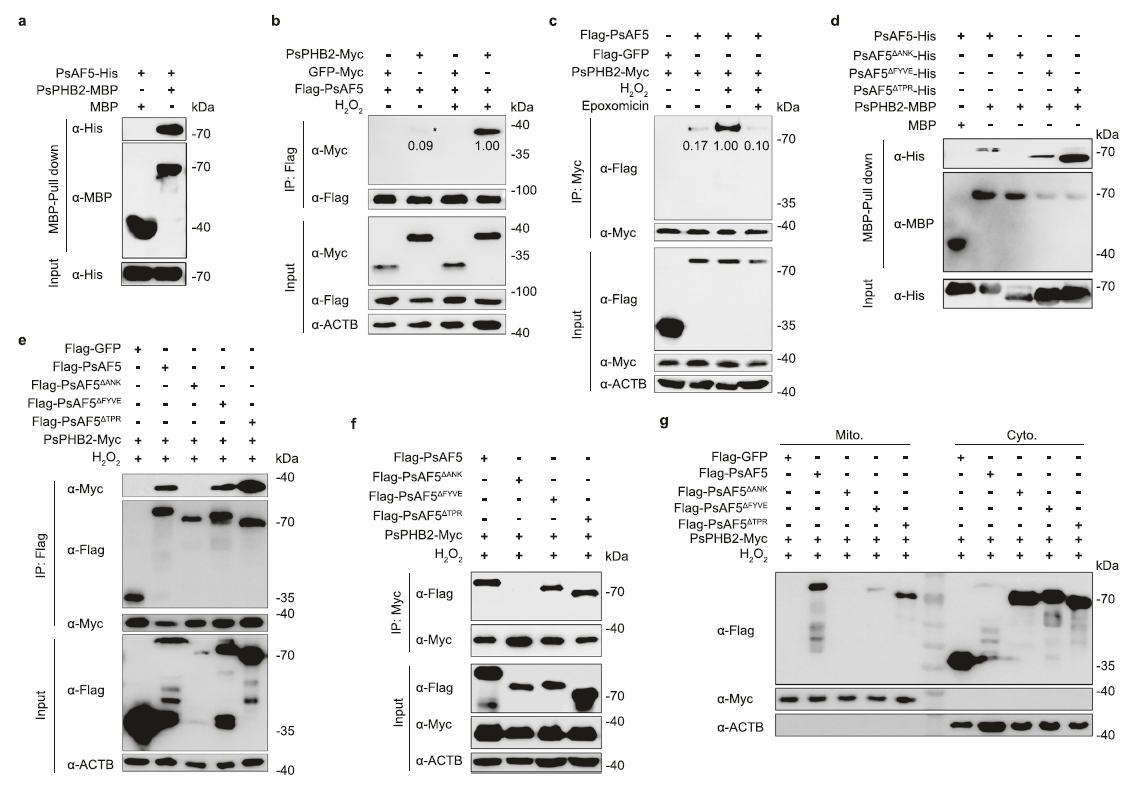
图2 PsAF5通过其ANK结构域与PsPHB2的互作而被招募到线粒体
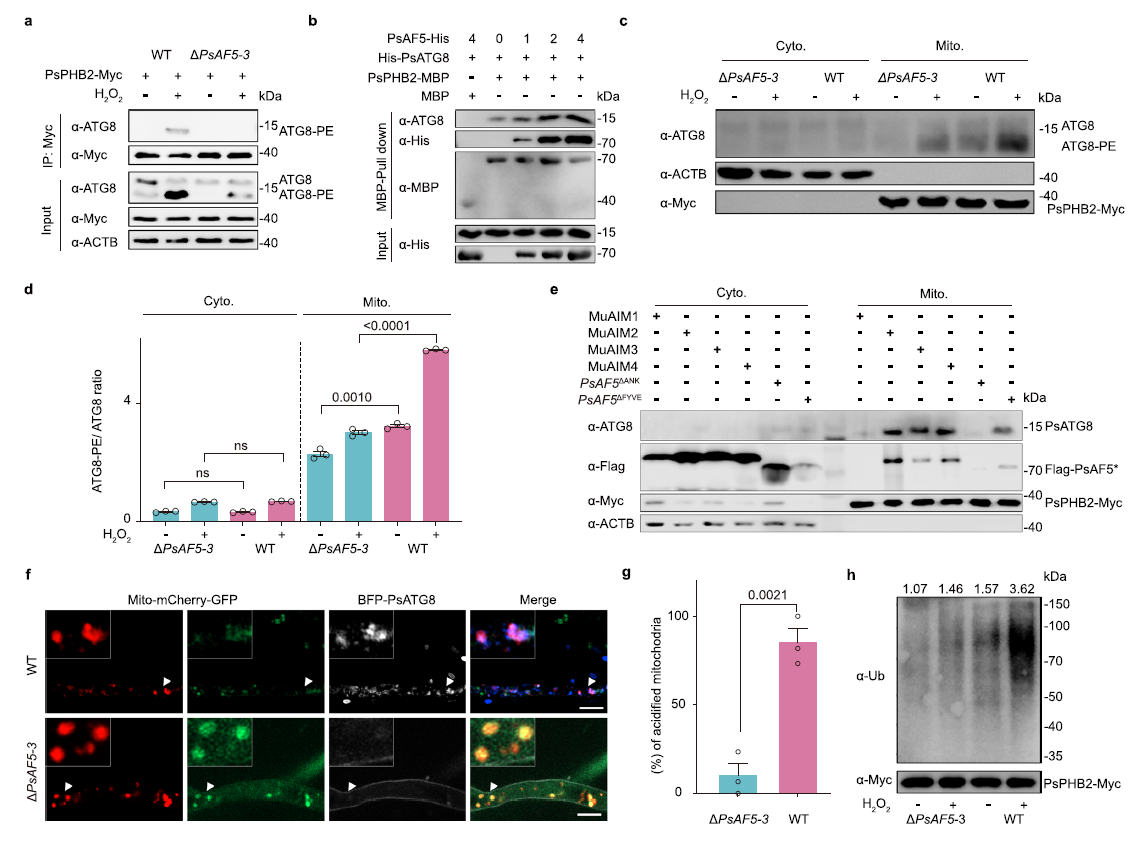
图3 PsAF5作为一个适配器将PsATG8募集到活性氧损伤的线粒体
综上,含有ANK和FYVE结构域的蛋白PsAF5作为线粒体内膜自噬受体PsPHB2的配体,为PsATG8与PsPHB2的互作搭建“桥梁”,将PsATG8招募到活性氧压力下受损的线粒体,启动线粒体自噬途径(图4)。

图4 PsAF5作为“配体”在活性氧诱导的线粒体自噬中的功能示意图
本研究首次发现一个新的配体蛋白PsAF5,在PsPHB2招募PsATG8中发挥“桥梁”的作用。由于AFs蛋白在不同真核生物中均存在,因此作者推测PHB2-AF5-ATG8蛋白复合体及其功能模式在其他真核生物中可能保守存在。研究结果丰富了人们对于真核生物受体介导型线粒体自噬的认识,同时也为新型药剂分子靶标的发掘提供了理论基础。
该研究工作得到了国家自然科学基金和陕西省科技创新团队等项目的资助。作物抗逆与高效生产全国重点实验室实验平台为研究工作完成提供了技术支持。
原文链接:https://www.nature.com/articles/s41467-024-46290-z