- 新闻焦点
-
我室沈锡辉教授研究团队揭示细菌VI型分泌系统新型杀菌机制
作者: 来源: 发布日期:2021-01-20 浏览次数:2021年 1月18 日,Nature Communications在线发表了我室沈锡辉教授团队完成的题为“Contact-independent killing mediated by a T6SS effector with intrinsic cell-entry properties”的研究论文,首次报道了假结核耶尔森氏菌第三套VI型分泌系统(T6SS-3)通过分泌一个新型Ca2+和Mg2+依赖性的DNA水解酶类效应蛋白,发挥接触非依赖型杀菌功能的新机制。
细菌VI型分泌系统广泛分布于革兰氏阴性细菌中,是一种近距离细菌-细菌间竞争武器。攻击者(供体菌)通过其类似于针管样的穿刺装置,直接刺穿被攻击者(受体菌)的细胞,将不同类型的杀菌毒素蛋白(如:细胞壁降解酶、核酸酶、膜穿孔蛋白、磷脂酶和NADase等)注射到被攻击者细胞内发挥特异的活性,杀死被攻击细菌,从而使攻击者细菌获得生长竞争优势。目前所有报道的T6SS杀菌武器都是接触依赖型的,即只有当攻击细菌与被攻击细菌细胞紧密接触时才能发挥杀菌功能,T6SS是否还能以非接触依赖型方式杀菌是该领域一个未解之谜。
在本研究中,研究者首先通过生信分析发现假结核耶尔森氏菌T6SS-3分泌一个完全未知的新型小分子量效应蛋白Tce1,仅由67个氨基酸残基组成,毒性实验和生化功能鉴定发现,Tce1是一个独特的小分子量Ca2+和Mg2+依赖的DNA水解酶,可降解细菌DNA,破坏其遗传物质发挥杀菌功能。进一步的细菌间竞争实验分析发现,Tce1不仅能够介导T6SS的接触依赖型杀菌功能,甚至当在液体培养时细菌细胞间无法紧密接触时,以及利用0.22 μm滤膜将供体菌与受体菌隔离开时,Tce1仍可介导T6SS的杀菌功能,表明假结核耶尔森氏菌T6SS-3利用特殊的效应蛋白Tce1,既可进行接触依赖型细菌竞争,也可进行接触非依赖型细菌竞争。研究者进一步推测,在细菌-细菌间非接触竞争作用中,毒素效应蛋白Tce1被攻击者细菌通过T6SS-3分泌到环境中后,必须通过识别并结合到被攻击者细菌某种特定的外膜受体蛋白上,通过跨膜转运,进入被攻击者细菌胞内,才能发挥其功能。通过一系列经典的受体蛋白分子鉴定与功能分析试验,研究者发现Tce1可识别并结合被攻击者细菌外膜上的受体蛋白分子BtuB和OmpF,进而借助细胞周质蛋白TolB 的参与,完成跨膜转运,进入被攻击者胞内发挥其杀菌功能。
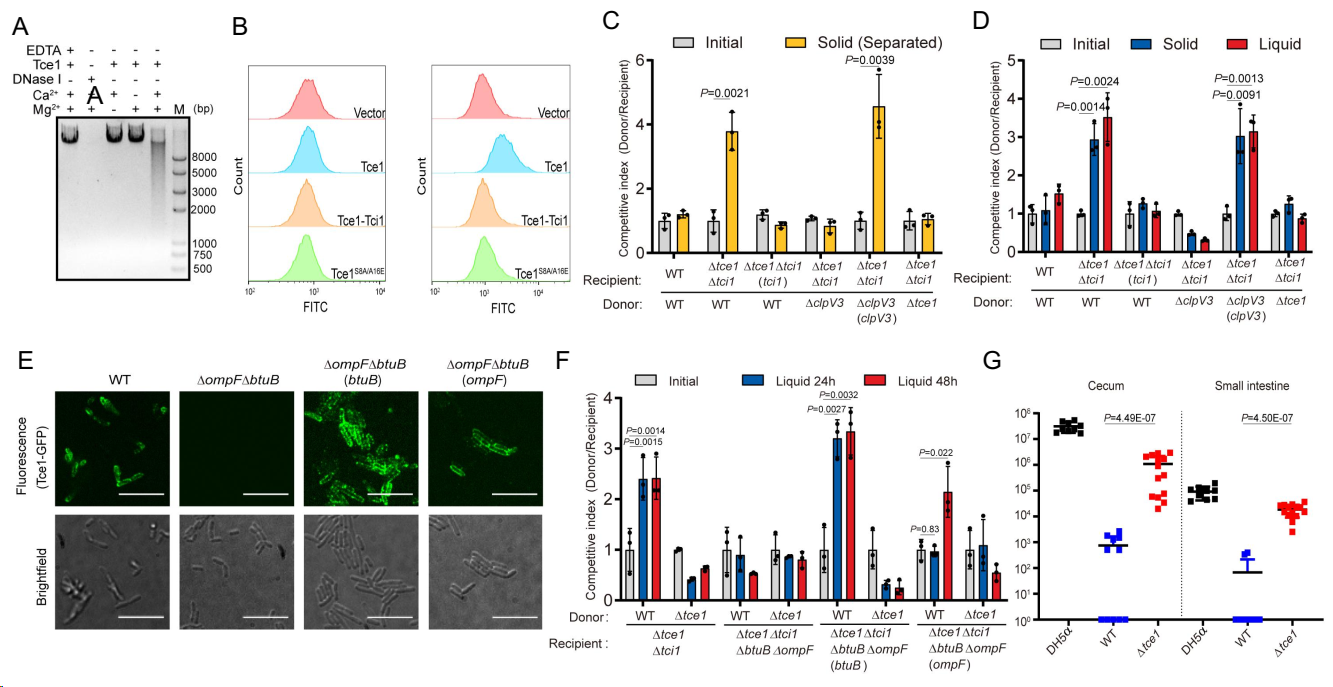
由此,T6SS-3代表了一种升级版的T6SS杀菌武器,既可像传统的近身作战型T6SS武器一样,利用其毒刺状分泌装置无差别刺穿近距离范围内的其它被攻击细菌,注射毒素进入其胞内发挥功能(在这一近身作战过程中,攻击者细菌自身也常常难以避免受到被攻击者细菌利用其T6SS进行的报复性反击);同时,对于远距离的被攻击细菌,攻击者细菌的T6SS-3像是一套精确制导的导弹发射装置,通过发射(分泌)Tce1样特异效应蛋白作为导弹,准确靶向外膜上具有特异受体分子的细菌,识别靶标,进入被攻击者胞内,发挥毒性杀死被攻击者细菌,同时还能避免被攻击者细菌T6SS的报复性反击。小鼠肠道内的细菌定殖和竞争试验也证实,T6SS-3赋予了假结核耶尔森氏菌更强的竞争能力,使其在复杂的肠道菌群中能通过激烈的竞争获得生态占位,实现肠道定殖。
假结核耶尔森T6SS-3借助独特效应蛋白Tce1发挥双模式杀菌功能现象的发现,在理论上极大的扩展了当前对于T6SS杀菌功能的认识,在实践中将为临床上耐药菌生物防控提供新的策略,也为以后Tce1样效应蛋白在农业病原菌的防治与环境生态治理中发挥重要作用奠定了理论基础。
我校博士生宋莉、青年教师潘君风和杨彦涛为本论文共同第一作者,沈锡辉教授和王瑶教授为本论文的共同通讯作者。此外,上海交通大学董涛教授也参与了本论文的部分研究。该研究得到了国家重点研发计划(2018YFA0901200)、国家自然科学基金(31725003、31670053、31970114 和31671292 )及西北农林科技大学双一流学科群建设计划等项目的资助。
相关附件:
