- 新闻焦点
-
我室单卫星教授课题组揭示未折叠蛋白应答参与疫霉病抗性调控机制
作者: 来源: 发布日期:2021-03-19 浏览次数:2021年3月15日,Plant Physiology在线发表了我室单卫星教授课题组题为“Susceptibility factor RTP1 negativelyregulates Phytophthora parasitica resistance via modulating UPR regulatorsbZIP60 and bZIP28”的研究论文,阐明了疫霉易感因子RTP1通过操纵内质网应激协同信号负调控植物抗性免疫的分子机制。
未折叠蛋白应答(UPR)是真核生物中保守的应激适应性信号转导途径,由内质网(ER)内错误折叠蛋白的积累所激活。UPR可在植物防御过程中引发,在植物与微生物的互作中起重要作用。据报道,植物UPR主要信号通路依赖于ER膜相关胁迫感应因子bZIP60和bZIP28的转录活性,而bZIP60和bZIP28是调控UPR基因表达的转录因子。尽管如此,对于ER相关或其调控过程如何参与易感因子介导植物免疫的分子机制仍不太清楚。
疫霉卵菌如马铃薯致病疫霉(Phytophthora infestans,晚疫病菌)、烟草寄生疫霉(Phytophthoraparasitica,黑胫病菌)等常常引发严重的作物病害,对世界范围内的可持续作物生产造成威胁。据报道,植物敏感性因子RTP1(resistance to Phytophthora parasitica 1)编码一个ER膜定位蛋白,并在感病早期影响水杨酸应答基因PR1的转录,但是,RTP1负调控植物抗性的分子机制在很大程度上是未知的。
本研究,为解析rtp1介导的植物抗性是否与ER应激信号调控协同发生,经初步鉴定发现,RTP1功能缺失导致衣霉素(内质网应激诱导剂)诱导的ER应激耐受性发生改变。同时,在P. parasitica早期侵染期间,RTP1功能缺失对UPR和ER应激相关免疫的诱导明显增强。
进一步分析表明,RTP1通过操纵双功能蛋白激酶/核糖核酸酶IRE1介导的bZIP60剪接活性并与bZIP28互作,促使ER结合类应激因子bZIP60和bZIP28趋于稳定。此外,抗病功能分析显示,rtp1bzip60和rtp1 bzip28突变植株对P. parasitica的抗性明显降低,并伴随ER应激免疫基因表达水平的显著下调以及胼胝体沉积的减少。这些结果表明UPR调控因子bZIP60和bZIP28可能作用于RTP1下游,并在rtp1介导的植株抗性中发挥重要作用。
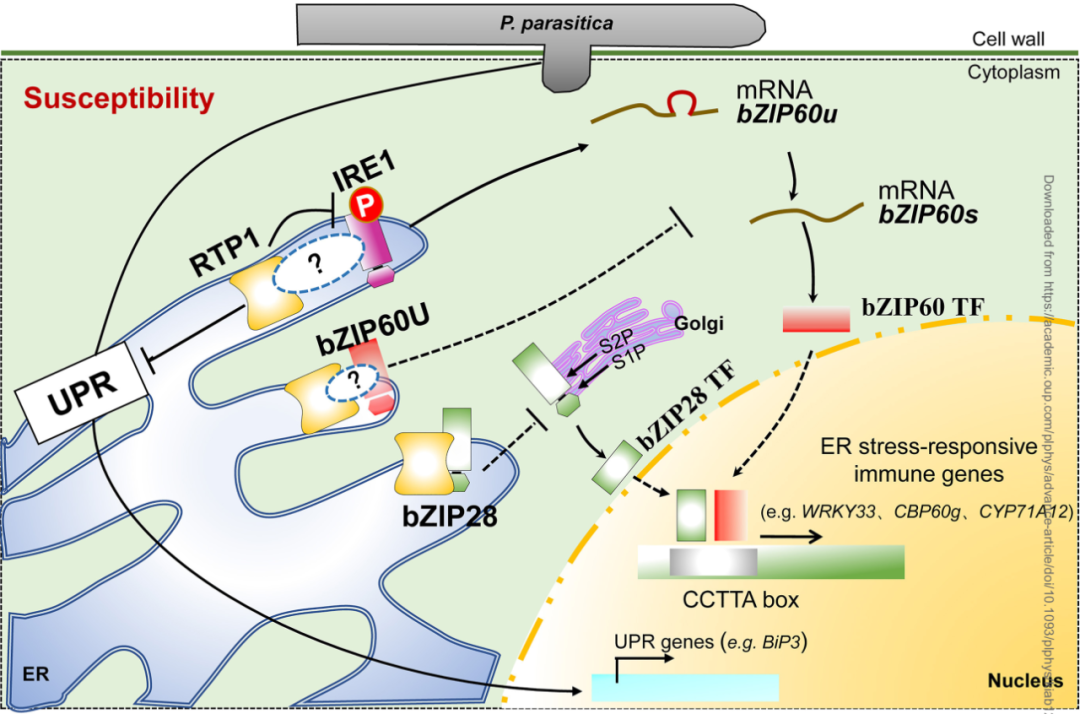
RTP1负调控植物免疫的工作示意图
总之,该研究解析了植物易感因子RTP1负调控生物营养型病原菌抗性的分子机制:RTP1参与UPR对寄生疫霉P.parasitica侵染的响应调控,并通过操纵IRE1介导的bZIP60剪接活性以及与bZIP28互作来进一步稳定ER膜相关的bZIP60和bZIP28应激元件,这最终减弱了活化bZIP60和bZIP28转录因子对下游UPR基因和ER胁迫应答免疫基因的激活。该项研究为胁迫适应性UPR和ER应激在植物免疫中的重要作用提供了新证据。